【行业】2018年仿制药一致性评价专题研究报告(70页)
仿制药一致性评价:中国医药行业2018年最重要的变革。2016年3月5日,国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号),标志中国仿制药质量和疗效一致性评价工作全面展开。仿制药一致性评价是中国医药行业2018年最重要的变革,大浪淘沙下,“剩”者为王,中国制药工业迎来长周期新起点。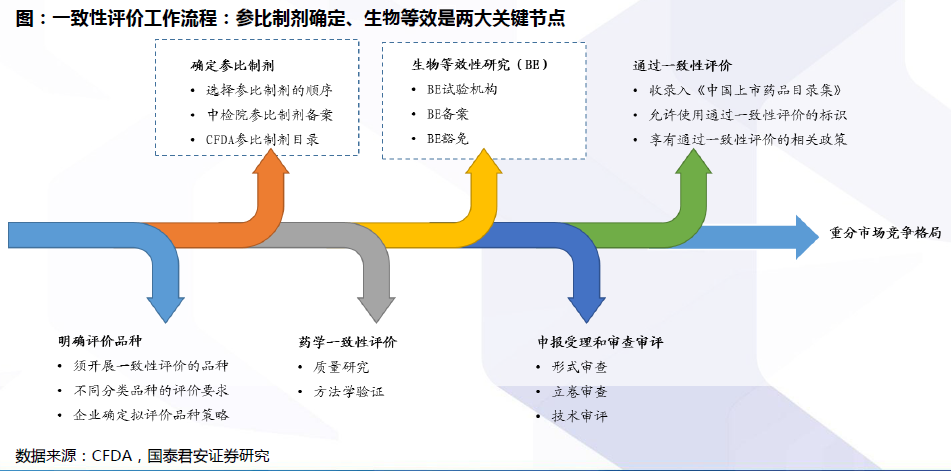
 评价范围:涉及11.6万批文,2018年底前完成17740批文。约涉及11.6个批文的仿制药。根据国家政策要求,化学药品新注册分类实施(2016年3月4日)前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。2018年底前需完成289个基药品种、17740个批文的评价工作。凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂,原则上应在2018年底前完成一致性评价。
评价范围:涉及11.6万批文,2018年底前完成17740批文。约涉及11.6个批文的仿制药。根据国家政策要求,化学药品新注册分类实施(2016年3月4日)前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。2018年底前需完成289个基药品种、17740个批文的评价工作。凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂,原则上应在2018年底前完成一致性评价。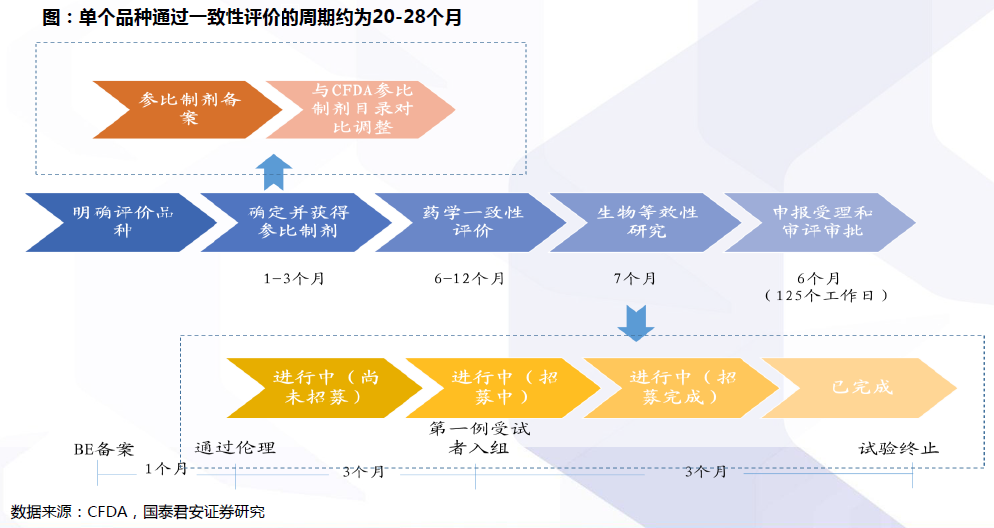
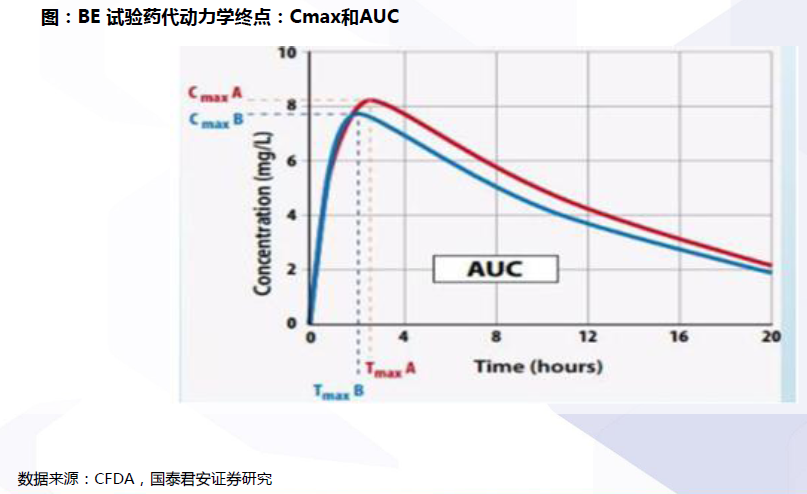
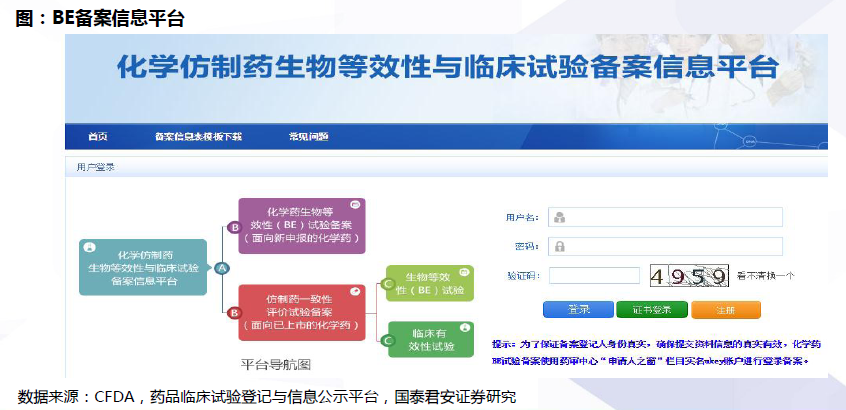 评价流程:确定参比制剂与开展BE试验是两大关键。开展仿制药质量和疗效一致性评价工作,要求已经批准上市的仿制药品, 在质量和疗效上与原研药品能够一致,临床上与原研药品可以相互替代。因此,一致性评价的两大关键为:确定参比制剂:参比试剂是指“用于仿制药质量和疗效一致性评价的对照药品,通常为被仿制的对象,如原研药品或国际公认的同种药物,参比制剂应为处方工艺合理、质量稳定、疗效确切的药品”。开展BE试验:生物等效性(BE)是指“在相似的试验条件下单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内”。
评价流程:确定参比制剂与开展BE试验是两大关键。开展仿制药质量和疗效一致性评价工作,要求已经批准上市的仿制药品, 在质量和疗效上与原研药品能够一致,临床上与原研药品可以相互替代。因此,一致性评价的两大关键为:确定参比制剂:参比试剂是指“用于仿制药质量和疗效一致性评价的对照药品,通常为被仿制的对象,如原研药品或国际公认的同种药物,参比制剂应为处方工艺合理、质量稳定、疗效确切的药品”。开展BE试验:生物等效性(BE)是指“在相似的试验条件下单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内”。

 评价范围:涉及11.6万批文,2018年底前完成17740批文。约涉及11.6个批文的仿制药。根据国家政策要求,化学药品新注册分类实施(2016年3月4日)前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。2018年底前需完成289个基药品种、17740个批文的评价工作。凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂,原则上应在2018年底前完成一致性评价。
评价范围:涉及11.6万批文,2018年底前完成17740批文。约涉及11.6个批文的仿制药。根据国家政策要求,化学药品新注册分类实施(2016年3月4日)前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。2018年底前需完成289个基药品种、17740个批文的评价工作。凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂,原则上应在2018年底前完成一致性评价。
 评价流程:确定参比制剂与开展BE试验是两大关键。开展仿制药质量和疗效一致性评价工作,要求已经批准上市的仿制药品, 在质量和疗效上与原研药品能够一致,临床上与原研药品可以相互替代。因此,一致性评价的两大关键为:确定参比制剂:参比试剂是指“用于仿制药质量和疗效一致性评价的对照药品,通常为被仿制的对象,如原研药品或国际公认的同种药物,参比制剂应为处方工艺合理、质量稳定、疗效确切的药品”。开展BE试验:生物等效性(BE)是指“在相似的试验条件下单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内”。
评价流程:确定参比制剂与开展BE试验是两大关键。开展仿制药质量和疗效一致性评价工作,要求已经批准上市的仿制药品, 在质量和疗效上与原研药品能够一致,临床上与原研药品可以相互替代。因此,一致性评价的两大关键为:确定参比制剂:参比试剂是指“用于仿制药质量和疗效一致性评价的对照药品,通常为被仿制的对象,如原研药品或国际公认的同种药物,参比制剂应为处方工艺合理、质量稳定、疗效确切的药品”。开展BE试验:生物等效性(BE)是指“在相似的试验条件下单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内”。




